L’àtom i la matèria. Conceptes fonamentals
.1) Marca amb una X
Càrrega positiva Càrrega negativa Sense càrrega
Protó [ ] [ ] [ ]
Electró [ ] [ ] [ ]
Neutró [ ] [ ] [ ]
Té massa Té una massa negligible
Protó [ ] [ ]
Electró [ ] [ ]
Neutró [ ] [ ]
Dins de l’àtom es troba a:
Nucli Escorça
Protó [ ] [ ]
Electró [ ] [ ]
Neutró [ ] [ ]
.2) Dibuixa un àtom segons el model de Rutherford. Fes un dibuix bonic.
• Pinta 5 protons de color verd amb un signe +
• Pinta 5 electrons de color groc amb un signe -
• Pinta 4 neutrons de color blau
• Com que la massa del electro és negligible davant la massa del protó o neutró fes les boles de l’electró més petites que les dels protons o neutrons
• Indica la part de l’escorça amb un color rosa clar
• Assenyala el nucli
.3) Freqüentement es veu l’àtom representat de la forma que teniu a la figura del costat. Llegiu el text que hi ha a la pàg. 63 (a la foto 4) del llibre de text i expliqueu quins aspectes d’aquesta representació de l’esquerra no coincideixen amb l’estructura real de l’àtom

4)
Element: Substància que no pot ésser descomposta en unes altres de més senzilles perquè està formada per un únic tipus d’àtoms.
L’or és un element. Cap químic al seu laboratori podria descomposar un anell d’or pur en altres substàncies diferents. És un element.
Tots elements coneguts estan recollits a la Taula periòdica. En l’actualitat es coneixen 103 elements.
Compost: Substància que es pot descomposar en unes altres de més senzilles perquè està formada per àtoms de més d’un tipus d’element.
L’aigua H2O és un compost. Està formada per àtoms d’hidrogen i oxigen. Al laboratori es pot fer passar un corrent elèctric per una quantitat d’aigua i aquesta es descomposa en hidrogen i oxigen. D’això se’n diu l’electrolisi de l’aigua

.a) Cita cinc substàncies que puguis trobar a casa teva o a l’ìnstitut que estiguin formades per elements. Intenta que hi hagi sòlides, líquides i gasoses
.b) Cita sis substàncies que puguis trobar a casa teva o a l’institut que estiguin formades per compostos. Intenta que hi hagi 2 sòlides, 2 líquides i 2 gasoses
.c) Quina és la diferència fonamental entre un element i un compost?
.d) De les següentes substancies digues quines es poden descomposar i quines no.
En cas que es puguin descomposar indica en quines substàncies
Ferro (Fe) [ ] no es pot descomposar en unes altres subtàncies més senzilles
[ ] es pot descomposar en: ……………………………………………………………
Sal de cuina (NaCl) [ ] no es pot descomposar en unes altres subtàncies més senzilles
[ ] es pot descomposar en: ……………………………………………………………
Amoníac (NH3) [ ] no es pot descomposar en unes altres subtàncies més senzilles
[ ] es pot descomposar en: ……………………………………………………………
Oxigen (O2) [ ] no es pot descomposar en unes altres subtàncies més senzilles
[ ] es pot descomposar en: ……………………………………………………………
Ozó (O3) [ ] no es pot descomposar en unes altres subtàncies més senzilles
[ ] es pot descomposar en: ……………………………………………………………
Nitrogen (N2) [ ] no es pot descomposar en unes altres subtàncies més senzilles
[ ] es pot descomposar en: ……………………………………………………………
Butà (C4H10) [ ] no es pot descomposar en unes altres subtàncies més senzilles
[ ] es pot descomposar en: ……………………………………………………………
.5) L’aire és una mescla de gasos (oxigen, nitrogen i altres). Si l’aire es pot separar en els altres gasos que el formen per què no diem que l’aire és un compost? (en la pag. 40 del llibre de text POSITRÓ 3 tens pistes per trobar la resposta)
.6) a) Fes un mapa conceptual on apareguin els conceptes:
• materia
• substàncies pures
• mescles
• elements
• compostos
• mescles homogènies
• mescles heterogènies
Escriu un breu definició de cada concepte a sota i els exemples quan ho demani:
.b) Classifica les següents substàncies:
Coure [ ] element [ ] compost [ ] mescla homogènia [ ] mescla heterogènia
Aigua de mar [ ] element [ ] compost [ ] mescla homogènia [ ] mescla heterogènia
Aigua [ ] element [ ] compost [ ] mescla homogènia [ ] mescla heterogènia
Granit [ ] element [ ] compost [ ] mescla homogènia [ ] mescla heterogènia
Oxigen [ ] element [ ] compost [ ] mescla homogènia [ ] mescla heterogènia
Suc de taronja [ ] element [ ] compost [ ] mescla homogènia [ ] mescla heterogènia
Gasolina [ ] element [ ] compost [ ] mescla homogènia [ ] mescla heterogènia
Diòxid de carboni [ ] element [ ] compost [ ] mescla homogènia [ ] mescla heterogènia
Carboni [ ] element [ ] compost [ ] mescla homogènia [ ] mescla heterogènia
Nitrogen [ ] element [ ] compost [ ] mescla homogènia [ ] mescla heterogènia
Acer [ ] element [ ] compost [ ] mescla homogènia [ ] mescla heterogènia
Ferro [ ] element [ ] compost [ ] mescla homogènia [ ] mescla heterogènia
Bronze [ ] element [ ] compost [ ] mescla homogènia [ ] mescla heterogènia
Sang [ ] element [ ] compost [ ] mescla homogènia [ ] mescla heterogènia
La Taula periòdica
.7) a) Numera de l’1 al 18 els grups de la taula periòdica
b) Numera de l’1 al 7 els períodes de la taula periòdica
c) Observa els elements anomenats Terres rares. En la pàgina 81 del llibre de text POSITRÓ 3 trobaràs els seus noms. Llegeixte’ls i escriu els noms que et sonin familiars, els que hagis sentit més d’una vegada.
Per què es posen separats i a sota?
.7) A l’anterior taula periòdica:
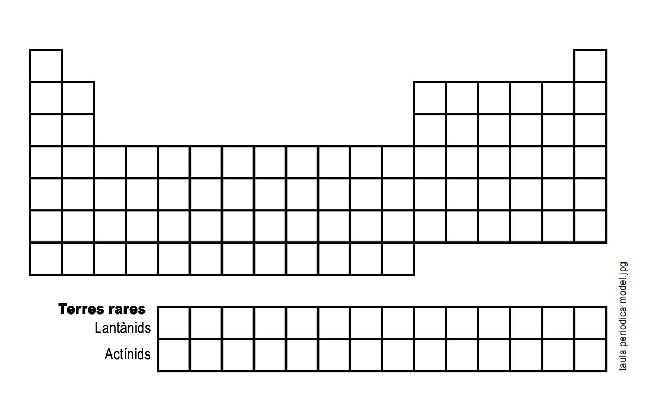
• pinta de blau els elements metàl·lics • posa un ratlla negra als elements sòlids
• pinta de taronja els elements no metàl·lics • posa un ratlla grisa als elements líquids
• pinta de verd els semimetalls • posa un ratlla lila als elements gasosos
.8) Segur que coneixes que el Ferro (Fe), el coure (Cu) o l’Or (Au) són metalls però digues si els següents elements són metalls o no metalls:
Calci. [ ] metall [ ] no metall Heli [ ] metall [ ] no metall
Bari [ ] metall [ ] no metall Tungstè [ ] metall [ ] no metall
Sodi [ ] metall [ ] no metall Carboni [ ] metall [ ] no metall
Iode [ ] metall [ ] no metall Hidrogen [ ] metall [ ] no metall
Oxigen [ ] metall [ ] no metall Magnesi [ ] metall [ ] no metall
Titani [ ] metall [ ] no metall Fluor [ ] metall [ ] no metall
.9) La taula periòdica s’anomena “periòdica” perquè es pot veure com evolucionen les propietats dels elements de forma periòdica (en cada període).
El tamany de l’àtom és una de les propietats periòdiques.
a) Marca una X
• Al llarg d’un període, cap a la dreta, el tamany de l’àtom [ ] augmenta [ ] disminueix
• Al llarg d’un grup, cap a baix, el tamany de l’àtom [ ] augmenta [ ] disminueix
b) Indica quin àtom és més gran:
• El liti [ ] o el potassi [ ]
• El carboni [ ] o el fluor [ ]
• El potassi [ ] o el calci [ ]
• El oxigen [ ] o el sofre [ ]
.10) Potser no hagis vist mai un tros de sodi. Pero creus que tindrà brillantor metàl·lica, serà un bon conductor de l’electricitat i serà maleable? Raona-ho
.11) RECORDA: N2, O2, F2, Cl2, Br2, I2
El elements que marquem en negre, es troben habitualment en forma diatòmica, o sigui, que són substàncies formades per molècules de dos àtoms (diatòmica).
L’hidrogen és una altra substància molt habitual en química que també és diatòmica.
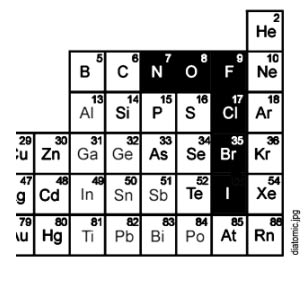
Així si en una reacció química intervé l’oxigen
no hem d’escriure O (sense cap subíndex),
hem d’escriure O2 (amb el subíndex 2)
I si apareéis, per exemple, l’hidrogen o el nitrogen, escriurem H2 o N2
Aquestes substàncies són totes gasoses en condicions ambient a excepció del brom que és un líquid vermell
Quasi tota la resta de substàncies les escriurem sense cap subíndex. Per exemple, l’or, el calci, el ferro les hem d’escriure amb el seu símbol sense subíndex: Au, Ca, Fe
Hi ha algunes substàncies que s’escriuen amb el seu símbol amb subíndex (amb 6, amb 8, amb 3, etc) però no es matèria d’aquest curs saber-les
Escriu el símbol de les substàncies elementals següents tal com es troben en condicions ambient:
Magnesi: Manganès Potassi
Clor Heli Niquel
Alumini Nitrogen Fluor
Plata Mercuri Liti
Enllaç químic.
.12) Els àtoms s’uneixen uns amb altres a través d’enllaços
Per què s’uneix un àtom amb un altre àtom?
D’una forma molt resumida direm que és perquè els àtoms volen tenir 8 electrons en la seva última capa de l’escorça ja que això els dóna estabilitat
Veiem un exemple:
El sodi Na té 1 electró en la seva capa 3 i 8 electrons en la seva capa 2. Si dóna l’electró de la capa 3 es quedarà amb vuit electrons en la capa 2 i per tant ja tindrà 8 electrons en la última capa
El Clor Cl té 7 electrons en la seva capa 3. Si agafa 1 electró i el posa a la capa 3, es quedarà amb vuit electrons per tant ja tindrà 8 electrons en la última capa
Per tant,
• El sodi Na vol donar 1 electró
• El Clor Cl vol agafar 1 electró
Si es troben 1 àtom de Na i 1 àtom de Cl, el Na li dona 1 electró al Cl i s’uneixen mitjançant un enllaç.
D’aquí que la fórmula del clorur de sodi sigui NaCl ( un àtom de Na amb 1 àtom de Cl)
Un altre exemple:
El Magnesi Mg té 2 electrons en la seva capa 3 i 8 electrons en la seva capa 2. Si dóna els 2 electrons de la capa 3 es quedarà amb vuit electrons en la capa 2 i per tant ja tindrà 8 electrons en la última capa
El Clor Cl ja sabem que vol agafar 1 electró
Un àtoms de Mg que vol donar 2 electrons necssitarà 2 àtoms de Cl perquè li agafin els 2 electrons que vol donar
D’aquí que la fórmula del clorur de magnesi sigui MgCl2 ( un àtom de Mg amb 2 àtoms de Cl)
Hi ha altres formes en que els àtoms s’enllacen que s’estudiaran més endavant
Formulació d’òxids
Un òxid és una combinació d’un element més oxigen
NOTA: 1) l'oxigen actua amb nombre d'oxidació -2
2) l'element pot ser qualsevol excepte el fluor, que és més electronegatiu que l'oxigen.
Formulació
a) Element (X) a l’esquerra, i Oxigen (O) a la dreta X O
b) El número que expressa la valència de l’oxigen es posa com a subíndex del símbol de l’element.
X2O
c) El número que expressa la valència de l’element (n), es posa com a un índex del símbol de l’origen.
X2On
d) Si n és múltiple de 2, es poden simplificar els valors dels subíndex. Ex. S2O4 passa a SO2
X2/2On/2
EXEMPLES:
Formuleu: òxid de manganès (VI)
a) Element (Mn) a l’esquerra, i Oxigen (O) a la dreta Mn O
b) El número que expressa la valència de l’oxigen (-2) es posa com a subíndex del símbol del manganès, però sense signe Mn2O
c) El número que expressa la valència del manganès (VI = +6), es posa com a subíndex del símbol de l’oxigen sense el signe + Mn2O6
d) Com que 2 i 6 són divisibles per 2 s'han de simplificar els valors dels subíndex.
Mn2/2O6/2 ---> MnO3 (El subíndex 1 no cal posar-lo)
Formuleu: òxid de ferro (III)
a) Element (Fe) a l’esquerra, i Oxigen (O) a la dreta Fe O
b) El número que expressa la valència de l’oxigen (-2) es posa com a subíndex del símbol del ferro, però sense signe - . Fe2O
c) El número que expressa la valència del ferro (III = +3), es posa com a subíndex del símbol de l’oxigen sense el signe + Fe2O3
d) Com que 2 i 3 no són divisibles per 2 no es poden simplificar els valors dels subíndex.
Formuleu: òxid d'alumini
Noteu que no hi ha cap nombre romà entre parèntesi. No cal perquè l'alumini només té una valencia que és +3
a) Element (Al) a l’esquerra, i Oxigen (O) a la dreta AlO
b) El número que expressa la valència de l’oxigen (-2) es posa com a subíndex del símbol de l’alumini, però sense signe Al2O
c) El número que expressa la valència del l’alumini (+3), es posa com a subíndex del símbol de l’oxigen sense el signe + Al2O3
d) Com que 2 i 3 no són divisibles per 2 no es poden simplificar els valors dels subíndex.
Escriu la fórmula dels següents òxids.
RECORDA
• L’oxigen sempre actua amb valència - 2
• Entre parèntesis, t’indiquem la valència de l’element. Si no hi ha cap valència vol dir que l’element només en té una que hauràs de buscar en la taula que et donem
• Has de simplificar
• El subíndex 1 no es posa
.13) Formuleu els següents òxids:
a)
.................................òxid de sodi
.................................òxid de rubidi
.................................òxid de plata
.................................òxid de níquel (II)
.................................òxid de bari
b)
.................................òxid de sodi
.................................òxid de cadmi
.................................òxid d’alumini
.................................òxid d’estany (II)
.................................òxid de plom (II)
c)
.................................òxid de platí (IV)
.................................òxid de coure (I)
.................................òxid de mercuri (I)
.................................òxid de liti
.................................òxid d’or (I)
Valències més freqüents Valencies.doc
Valències, estats d’oxidació i nombres d’oxidació són expressions equivalents
http://www.telefonica.net/web2/faroinfo/1rBAT/Formulaci%97/Estats%20oxidacio.html
.14) Considera aquestes fòrmules moleculars:
H2SO4, C2H12O6, HNO3, CH2 (COOH) 3,
a) Quins elements constitueixen cadascun dels elements compostos?
H2SO4 …………………………………………………………………………
C2H12O6 …………………………………………………………………………
HNO3 …………………………………………………………………………
CH2 (COOH) 3 …………………………………………………………………………
b) Indica el nombre total d'àtoms que hi ha en cadascuna de les seves molècules.
H2SO4 àtoms de H ………… àtoms de S ………… àtoms de O …………
C2H12O6 àtoms de C ………… àtoms de H ………… àtoms de O …………
HNO3 àtoms de H ………… àtoms de N ………… àtoms de O …………
CH2 (COOH) 3, àtoms de C ………… àtoms de H ………… àtoms de O …………
.15) Fixa't en aqüestes fòrmules que corresponen a compostos de calci:
CaS2, CaCO3, Ca(OH) 2, CaSO4, Ca3(PO4) 2, CaO, Ca2SiO4.
a) Ordena-les de menys a mes nombre d'àtoms de calci.
b) Ordena-les de menys a més nombre d'àtoms en total.
