
biotecnologías

 |
Bioética: Desde las biotecnologías |
 |
|
1. Eugenesia e ingeniería genética La eugenesia del pasado Si bien la eugenesia como estudio de las posibilidades de mejoramiento del patrimonio hereditario, no apareció hasta finales del siglo XIX, la preocupación y el deseo de preservar y mejorar la calidad de la especie humana proviene de muy antiguo. Fue Francis Galton, primo de Charles Darwin, quién, el 1883, introdujo el término eugenesia (del griego eu, bueno y genos, nacimiento, raza) y quién replanteó el problema de la mejora poblacional; pero griegos y romanos, entre otros pueblos, ya tomaron medidas eugénicas. El infanticidio fue una de ellas. Platón y Aristóteles lo exigían para los recién nacidos con malformaciones y el Derecho Romano reconocía la potestad del padre de matar al hijo deforme. En contra, el cristianismo, desde sus inicios, condenó tal medida eugénica.
El siglo XX ha estado marcado por las prácticas eugénicas. En sus primeras décadas, diferentes estados de EE.UU. promulgaron y aplicaron leyes de esterilización de personas con alguna supuesta deficiencia. A mediados siglo, el nazismo, inspirado y estimulado por criterios eugénicos, practicó horrorosos experimentos con el objetivo de asegurar la superioridad de la raza aria. En la segunda mitad del siglo, en Escandinavia, hasta entrado el año 1975, se aplicaron medidas de esterilización forzada; durante décadas, el silencio cubrió esta práctica y en el 1995 se indemnizaron mujeres víctimas de esta práctica De la genética a la ingeniería Cien años después del descubrimiento de las célebres leyes de Mendel sobre la herencia (del 1866), la genética había adelantado poco en relación a los avances de las otras ciencias. Se habían identificado y contado las cromosomas humanos y, en el año 1953, James Watson y Francis Crick habían descubierto la estructura en doble hélice del ADN (el Ácido DesoxirriboNucleico es el soporte de la información genética). Fue con los primeros experimentos de clonación humana, por división de un embrión inicial, el 1973, cuando la genética recibió su gran impulso iniciándose lo que hoy se llama ingeniería genética. Poco después, el 1978, nació en gran Bretaña el primer neonato probeta, concebido por fecundación in vitro.
Ventajas y riesgos Algunos temen que la ingeniería genética llegará a ser una nueva eugenesia. Otros aseguran que las ventajas superarán en mucho a los posibles abusos. Se perfilan posibilidades, interrogantes y riesgos. ¿Se impondrá un modelo fenotípico, una "normalidad" a la cual los padres querrán ajustar sus hijos? ¿Se va a producir un empobrecimiento de la diversidad genética? ¿Van a tener los padres libertad de acción frente a los influyentes intereses comerciales? Recordemos que ésta biotecnología implica altísimos costes y son objeto de las inversiones de muchas multinacionales. La Bioética tiene que formular interrogantes y no tener miedo al progreso, pero sí ha de estar atento a los intereses del hombre que administra el progreso. |
|
3. Proyecto Genoma Humano A partir de 1985, un gran número de investigadores encabezados por James Watson, el codescubridor de la estructura del ADN, concibieron la posibilidad de investigar las instrucciones presentes en el conjunto de los genes humanos. Esta ambiciosa y costosa posibilidad fue identificada con el nombre de Proyecto sobre el Genoma Humano. Un gen es una porción de ADN que, solo o asociado a otros, es responsable de la realización de una característica. El conjunto de genes de un organismo constituye el su genoma. El genoma, conservado en el ADN, se el programa hereditario de un ser vivo, un programa que determina las funciones biológicas de éste ser vivo. A medida que han adelantado las búsquedas, se han ido reduciendo las estimaciones sobre el número de genes que constituyen el genoma humano: de los 100.000 iniciales se pasó a hablar de 60.000 a 80.000 genes, y en el 2001 la estimación era de 30.000 y pico genes. Las instrucciones, como en todo ser vivo, se hallan codificadas mediante secuencias de cuatro bases: la adenina, la [tianina], la citosina y la guanina, simbolizadas, sucesivamente, con A, T, C y G. 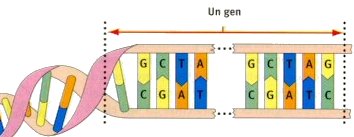 El 1990, el Proyecto del Genoma Humano ya estaba en marcha. Si bien varios países participaban en el Proyecto, su principal impulsor fueron los EE.UU. con un presupuesto anual de unos 200 millones de dólares. El objetivo de este Consorcio Público consistía en localizar e identificar todos los genes del ADN antes del 2003. Este objetivo suponía conocer la secuencia de la totalidad de los genes presentes en los cromosomas, es decir, un catálogo o mapa del genoma humano. El resultado sería la secuencia de tres mil millones de letras (una alternancia de A, T, C y G, que indican las cuatro bases) que compone los genes de los 23 cromosomas. El paso siguiente y complementario sería comprender las funciones codificadas de cada gen e identificar los genes responsables de las enfermedades genéticas. El Proyecto incluía elaborar mapas y secuencias de los genomas de organismos evolutivamente sencillos, como modelos de estudio y análisis. Así, el 1998, por primera vez, se había descifrado el programa genético completo de un microscópico gusano, un organismo que tiene muchos genes comunes con el ser humano . El Proyecto incluye, también, el estudio de las consecuencias éticas, legales y sociales que puedan derivarse de la adquisición y utilización de este conocimiento. El 15 de febrero de 2001, el Consorcio Público presentaba, bastante antes de lo previsto, un primer borrador del genoma. El día siguiente, la empresa privada Celera, creada el 1998 por Craig Venter, asumiendo las investigaciones provenientes del Consorcio HUGO, también comunicaba su propio borrador del genoma. El rápido éxito de Celera se debía a las enormes inversiones hechas por diversas empresas de biotecnología. Obviamente, queda abierto el debate sobre la propiedad, pública o privada, de las investigaciones sobre el genoma humano; sus aplicaciones médicas pueden generar grandes beneficios económicos. El estudio sistemático del genoma humano, una proeza biotecnológica comparada por algunos a la llegada a la Luna, implicará importantes beneficios médicos, por ejemplo, intervenir en más de 4.000 enfermedades genéticas. Se argumenta que, con diferentes pruebas, se podrán hacer diagnósticos prenatales y, en un segundo momento, iniciar una terapia genética, unas terapias germinales que permitirán modificar o "purificar" el genoma del embrión. En la primera mitad de 1999, la investigación sobre el genoma humano ya había llevado a identificar los genes relacionados con la diabetes, al cáncer de mama y a la enfermedad de Alzheimer. Pero el proyecto ha recibido diversas críticas, tanto desde el punto de vista técnico como ético o religioso. Se objeta que no se puede hablar de una secuencia genética preestablecida: todos los individuos tienen una secuencia diferente y única: ¿cuál será la secuencia "normal" o punto de referencia? Se ofrecerán multitud de pruebas biogenéticas -todas patentadas y lucrativas- que no se sabe bien a quien beneficiarán. Se critica que el proyecto, con altísimos costes, deja de lado un factor fundamental, el peso del ambiente y la educación a la hora de configurar el ser humano. Por otro lado, ¿quién gestionará esta información? ¿Qué compañía asegurará un individuo o grupo portador de un genoma con predisposición a enfermedades hereditarias? ![[Human] Genoma [Organization]](hugo.jpg) Actualmente, pese a que la «Human Genoma Organization» (HUGO) intenta coordinar diferentes programas de investigación de dieciocho países, predomina la descoordinación y no siempre se sabe la línea de investigación de determinados grupos. Las legislaciones estatales van bastante atrasadas respeto a los resultados obtenidos y a los intereses de las multinacionales que han hecho sus inversiones. |
|
4. Alimentos transgénicos ¿Qué son los alimentos transgénicos? Son organismos, plantas o animales, que han sido manipulados genéticamente. ¿Como se manipulan? Haciendo uso, especialmente, de la biotecnología de recombinación del ADN: se implanta en las células de determinados organismos como por ejemplo plantas, material genético proveniente de otros organismos dotados de ciertas cualidades, con el objetivo de dotar con estas cualidades al organismo receptor o manipulado. Así, pues, los alimentos transgénicos son organismos modificados mediante ingeniería genética. ¿Qué efectos producen en los animales o humanos que los ingieren? Ésta es la cuestión conflictiva, mucho más cuando investigadores que participan en el Proyecto Genoma Humano han afirmado que los riesgos que comporta son muy desconocidos.  Instituciones internacionales han advertido del nuevo peligro que suponen los alimentos transgénicos. Se teme que a la lista negra de efectos nocivos y tóxicos causados por el gran número de plaguicidas y sustancias químicas insuficientemente controladas se habrá de añadir los efectos, por el momento imprevisibles, causados por la contaminación transgénica, tanto o más grave que la contaminación química.
Por otro lado, las semillas de las plantas transgénicas, que pueden aumentar los rendimientos del 15% al 20%, introducen el problema de las patentes de plantas o animales creados. Si una multinacional, haciendo millonarias inversiones, ha conseguido crear un trigo o un arroz de alto rendimiento, el agricultor que las compra ¿tiene derecho a replantarlas una y otra vez? Ciertamente, desde hace más de 10.000 años, los agricultores han reservado parte de las semillas obtenidas en cosechas para la replantación o intercambios; ahora bien, las multinacionales argumentan que las semillas transgénicas son creaciones patentadas y su compra sólo da derecho a plantarlas una vez, cosa que se hace constar en el contrato de compra. Con el objetivo que no se escapen los beneficios de la inversión, las multinacionales de la biotecnología agrícola han patentado el «sistema de protección tecnológica» (Technology Protection System, TPS), un polémico y controvertido sistema de protección que comporta la esterilización de las semillas. Modificando tres genes de las semillas se consigue neutralizar las semillas obtenidas en la cosecha: si se replanta, la semilla no germina. Éstas semillas TPS son conocidas por sus muchos detractores con el nombre de "Terminator". Los efectos ambientales, económicos y sociales de las entonces Terminator son incalculables. |