|
1. Eugenèsia i enginyeria genètica L'eugenèsia del passat Si bé l'eugenèsia com estudi de les possibilitats de millorament del patrimoni hereditari, no aparegué fins a finals del segle XIX, la preocupació i el desig de preservar i millorar la qualitat de l'espècie humana prové de molt antic. Certament, fou Francis Galton, cosí de Charles Darwin, qui, el 1883, introduí el terme eugenèsia (del grec eu, bo i genos, naixement, raça) i qui replantejà el problema del millorament de la població; però grecs i romans, entre altres pobles, ja prenien mesures eugèniques. L'infanticidi n'era una. Plató i Aristòtil l'exigien pels nounats amb malformacions i el Dret Romà reconeixia la potestat del pare de matar el fill deforme. En contra, el cristianisme, des dels seus inicis, condemnà aquesta mesura eugènica.
El segle XX ha estat marcat per les pràctiques eugèniques. A començaments de segle, diferents estats dels EUA promulgaren i aplicaren lleis d'esterilització de persones amb alguna suposada deficiència. A mitjans segle, el nazisme, inspirat i estimulat per criteris eugènics, practicà horrorosos experiments amb l'objectiu d'assegurar la superioritat de la raça ària. A la segona meitat del segle, a Escandinàvia, fins entrat l'any 1975, s'aplicaren mesures d'esterilització forçada; durant dècades, el silenci cobrí aquesta pràctica i el 1995 s'indemnitzaren les dones que en foren víctimes De la genètica a l'enginyeria Cent anys després del descobriment de les cèlebres lleis de Mendel sobre l'herència (del 1866), la genètica havia avançat poc en relació als avenços de les altres ciències. S'havien comptat les cromosomes humans i, al 1953, James Watson i Francis Crick havien descobert l'estructura en doble hèlix de l'ADN (l'Àcid DesoxiriboNucleic és el suport de la informació genètica). Fou amb els primers experiments de clonació humana, per divisió d'un embrió inicial, el 1973, quan la genètica rebé el seu gran impuls iniciant-se el que avui s'anomena enginyeria genètica. Poc després, el 1978, naixé a la Gran Bretanya el primer nadó proveta, concebut per fecundació in vitro.
Avantatges i riscos Alguns temen que l'enginyeria genètica esdevindrà una nova eugenèsia. Altres asseguren que les avantatges superaran en molt als possibles abusos. Es perfilen possibilitats, interrogants i riscos. S'imposarà un model fenotípic, una "normalitat" a la qual els pares voldran ajustar els seus fills? Es produirà un empobriment de la diversitat genètica? Tindran els pares llibertat d'acció davant els influents interessos comercials? Recordem que aquesta biotecnologia implica altíssims costos i són objecte de les inversions de moltes multinacionals. La Bioètica ha de formular interrogants i no tenir por al progrés, però sí ha d'estar atent als interessos de l'home que administra el progrés. |
|
3. Projecte sobre el Genoma Humà A partir de 1985, un gran nombre d'investigadors encapçalats per James Watson, el codescobridor de l'estructura de l'ADN, van concebre la possibilitat d'investigar les instruccions presents en el conjunt dels gens humans. Aquesta ambiciosa i costosa possibilitat fou identificada amb el nom de Projecte sobre el Genoma Humà. Un gen és una porció d'ADN que, sol o associat a d'altres, és responsable de la realització d'un caràcter. El conjunt de gens d'un organisme constitueix el seu genoma. El genoma, conservat en l'ADN, es el programa hereditari d'un ésser viu, un programa que determina les funcions biològiques d'aquest ésser viu. A mesura que han avançat les recerques, s'han anat reduint les estimacions sobre el nombre de gens que constitueixen el genoma humà: dels 100.000 inicials es passà a parlar de 60.000 a 80.000 gens, i el 2001 l'estimació era de 30.000 gens. Les instruccions, com en tot ésser viu, hi estan codificades mitjançant seqüències de quatre bases: l'adenina, la tianina, la citosina i la guanina, simbolitzades, successivament, amb A, T, C i G. 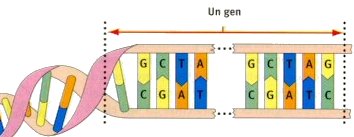 El 1990, el Projecte del Genoma Humà ja estava en marxa. Si bé varis països hi participaven, el seu principal impulsor foren els EUA, amb un pressupost anual d'uns 200 milions de dòlars. L'objectiu d'aquest Consorci Púbñic: localitzar i identificar tots els gens de l'ADN abans del 2003. Aquest objectiu suposa conèixer la seqüència de la totalitat dels gens presents en els cromosomes, és a dir, un catàleg o mapa del genoma humà. El resultat serà la seqüència de tres mil milions de lletres (una alternança d'A, T, C i G, que indiquen les quatre bases) que compon els gens dels 23 cromosomes. El pas següent i complementari serà comprendre les funcions codificades de cada gen i identificar els gens responsables de les malalties genètiques. El Projecte inclou elaborar mapes i seqüències dels genomes d'organismes evolutivament senzills, com a models d'estudi i anàlisi. Així, el 1998, per primera vegada, s'havia desxifrat el programa genètic complet d'un microscòpic cuc, un organisme que té molts gens comuns amb l'ésser humà . El Projecte inclou, també, l'estudi de les conseqüències ètiques, legals i socials que puguin derivar-se de la adquisició i utilització d'aquest coneixement. El 15 de febrer de 2001, el Consorci Públic presentava, força abans del previst, un primer esborrany del genoma. El dia següent, l'empresa privada Celera, creada el 1998 per Craig Venter tot assumint les recerques provinents del Consorci HUGO, també comunicava el seu propi esborrany del genoma. El ràpid èxit de Celera es degut a les enormes inversions fetes per diverses empreses de biotecnologia. Òbviament, queda obert el debat sobre la propietat, pública o privada, de les recerques sobre el genoma humà; les seves aplicacions mèdiques poden generar grans beneficis econòmics. L'estudi sistemàtic del genoma humà, una proesa biotecnològica comparada per alguns a l'arribada a la Lluna, implicarà importants beneficis mèdics, per exemple, intervenir en les mes de 4.000 malalties genètiques. Així, s'argumenta, amb diferents proves es podran fer diagnòstics prenatals i, en un segon moment, iniciar una teràpia genètica, unes teràpies germinals que permetran modificar o "purificar" el genoma de l'embrió. A la primera meitat de 1999, la investigació sobre el genoma humà ja havia portat a identificar els gens lligats a la diabetis, al càncer de mama i a la malaltia d'Alzheimer. Però el projecte ha rebut diverses crítiques, tant des del punt de vista tècnic com ètic o religiós. S'objecta que no es pot parlar d'una seqüència genètica preestablerta: tots els individus tenen una seqüència diferent i única: quina serà la seqüència "normal" o punt de referència? S'oferiran multitud de proves biogenètiques -totes patentades i lucratives- que no se sap bé a qui beneficiaran. Es critica que el projecte, amb altíssims costos, deixa de banda un factor fonamental, el pes de l'ambient i l'educació a l'hora de configurar l'ésser humà. Per altra banda, qui gestionarà aquesta informació? Quina companyia assegurarà un individu o grup portador d'un genema amb predisposició a malalties hereditàries?  Actualment, malgrat la «Human Genoma Organization» (HUGO) intenta coordinar diferents programes de recerca de divuit països, predomina la descoordinació i no sempre se sap la línia de recerca de determinats grups. Les legislacions estatals van força enraderides respecte als resultats obtinguts i als interessos de les multinacionals que han fet les seves inversions. |
|
4. Aliments transgènics Què son els aliments transgènics? Són organismes, plantes o animals, que han estat manipulats genèticament. Com es manipulen? Fent ús, especialment, de la biotecnologia de recombinació de l'ADN: s'implanta en les cèl·lules de determinats organismes com ara plantes, material genètic provinent d'altres organismes dotats de certes qualitats, amb l'objectiu de dotar amb aquestes qualitats a l'organisme receptor o manipulat. Així, doncs, els aliments transgènics són organismes modificats mitjançant enginyeria genètica. Quins efectes produeixen en els animals o humans que els ingereixen? Aquesta és la qüestió conflictiva, molt més quan investigadors que participen en el projecte Genoma Humà han afirmat que els riscos que comporta són molt desconeguts.  Institucions internacionals han advertit del nou perill que suposen els aliments transgènics. Es tem que la a llista negra d'efectes nocius i tòxics causats pel gran nombre de plaguicides i substàncies químiques insuficientment controlades s'hi haurà d'afegir els efectes, de moment imprevisibles, causats per la contaminació transgènica, tant o més greu que la contaminació química.
Per altra banda, les llavors de les plantes transgèniques, que poden augmentar els rendiments del 15% al 20%, introdueixen el problema de les patents de plantes o animals creats. Si una multinacional, fent milionàries inversions, ha aconseguit crear un blat o un arròs d'alt rendiment, l'agricultor que les compra té dret a replantar-les una i altra vegada? Certament, des de fa més de 10.000 anys, els agricultors han reservat part de les llavors obtingudes en collites per a la replantació o intercanvis; ara bé, les multinacionals argumenten que les llavors transgèniques són creacions patentades i la seva compra només dóna dret a plantar-les una vegada, cosa que fan constar en el contracte de compra. Amb l'objectiu que no s'escapin els beneficis de la inversió, les multinacionals de la biotecnologia agrícola han patentat el «sistema de protecció tecnològica» (Technology Protection System, TPS), un polèmic i controvertit sistema de protecció que comporta l'esterilització de les llavors. Modificant tres gens de les llavors s'aconsegueix neutralitzar les llavors obtingudes en la collita: si es replanta, la llavor no germina. Aquestes llavors TPS són conegudes pels seus molts detractors amb el nom de "Terminator". Els efectes ambientals, econòmics i socials de les llavors Terminator són incalculables. |