| | Començar
| Experiments | Galeria
de Fotos | Glossari | Jocs
| Pedagogia | Sortir
| |
|
|
| Estequiometria |
| L'estequiometria és l'estudi de les quantitats relatives de
substàncies implicades en un canvi químic. Resoldre els problemes
estequiomètrics és especialment important en camps com la
química de l'alimentació, els medicaments i en general en
qualsevol indústria on es fabriquen productes químics. |
|
| Coeficients
estequiomètrics |
| en l'apartat "reaccions químiques"
hi havia una equació escrita:
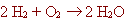
Havíem dit que es llegia: "l'hidrogen reacciona amb l'oxigen
per a produir aigua", però no vam fer cap comentari dels nombres
que apareixien al costat de l'hidrogen i de l'aigua. Aquests nombres (inclòs
l'1 que no apareix davant l'oxigen), se'ls anomena coeficients
estequiomètrics, i ens asseguren que hi ha el mateix nombre
d'àtoms abans i després de produir-se la reacció química. |
|
Si recordem el que s'ha dit en l'esmentat apartat: "En una reacció
química es trenquen els enllaços de les substàncies
inicials (reactius) i es formen altres enllaços que donen lloc a
les noves substàncies (productes)". Ens adonem que, un cop ha tingut
lloc la reacció química, continua havent el mateix nombre
(de cada mena) d'àtoms que hi havia a l'inici de la reacció,
però organitzats de maneres diferents. Així doncs, en la
reacció anterior:
| Abans de la reacció |
Després de la reacció |
| H: 2 H2
= |
H-H + H-H |
2x2 H = 4 H |
H: 2 H2O = |
H-O-H + H-O-H |
2x2 H = 4 H |
| O: 1 O2 = |
O-O |
1x2 O = 2 O |
O: 2 H2O = |
H-O-H + H-O-H |
2x1 O = 2 O |
|
|
| Per a ser més clars, hem escrit en verd els nombres corresponents
als coeficients estequiomètrics, i en castany els corresponents
als subíndex de cadascuna de les molècules (recordem l'apartat
símbols
i fórmules). Adonem-nos que hi ha el mateix nombre d'àtoms
d'hidrogen abans de la reacció que després (4), i que el
mateix passa amb l'oxigen (2). |
|
| Això vol dir que si nosaltres volem formar aigua a partir d'hidrogen
i d'oxigen haurem de posar doble quantitat en mols d'hidrogen que
d'oxigen. Si en posem més, sobrarà hidrogen, i si en posem
menys, sobrarà oxigen. |
|
| Igualar
equacions |
| Diem igualar equacions a trobar els coeficients estequiomètrics
adequats per tal que es compleixi la norma de mantenir el mateix nombre
d'àtoms (de cada mena) en els reactius i en els productes. Algunes
equacions, com l'anterior de l'obtenció de l'aigua, són senzilles
i es poden igualar fàcilment, però en d'altres haurem d'anar
per tempteig o utilitzant mètodes específics del tipus de
reacció (combustió, redox, etc.) |
|
| En tot cas, hem d'anar molt en compte a no oblidar-nos dels subíndex,
dels subíndex que afecten parèntesi i dels coeficients estequiomètrics
alhora d'igualar equacions. |
|
Si sabeu una mica d'anglès, podeu anar als enllaços següents,
on, si escriviu la reacció que voleu igualar, us la retorna amb
els coeficients estequiomètrics correctes:
Igualador
químic (1)
Igualador
químic (2) |
|
|
|
| Darrera actualització:
|
![]()